| IUPAC 명칭 | Tricyclo[8.4.0.02,7]tetradeca-1,3,5,7,9,11,13-heptaene |
|---|---|
| 영문 관용명 | Phenanthrene |
| 한국어 | 페난트렌 |
| 일본어 | フェナントレン [fuenantoren] |
| 중국어 | 菲 [fěi][1] |
| 독일어 | Phenanthren |
개요[편집 | 원본 편집]
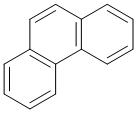
벤젠고리 3개가 지그재그로 나열된 형태로 탄소원자 2개씩을 공유해서 만든 여러고리 방향족 탄화수소.
주요 특성[편집 | 원본 편집]
| CAS 일련번호 | 85-01-8 |
|---|---|
| 분자식 (분자량) | C14H10 (178.24g mol-1) |
| 상온 상압에서 성상 | 자극적 냄새가 나는 백색의 결정성 가루 |
| 비중 | 1.18 (STP) |
| 녹는점 / 끓는점 | 101℃ / 332℃ |
| 용해도(물) | 0.2mg/100g water |
두 가지 세고리 방향족 탄화수소(polycyclic aromatic hydrocarbon, PAH)중 하나다. 나머지 하나는 안트라센. 고등학교 교과서에는 잘 안나온다. 안트라센과 마찬가지로 페난트렌 결정은 기본적으로 무색을 띄지만 자외선을 쪼이면 청색 형광을 낸다. 총 14개의 전자를 가지고 있어서 휘켈 규칙에 맞아떨어져 방향족으로 예측이 가능하다.
안트라센에 비해 녹는점이 무려 100도가량 낮다. 안트라센은 215도에서 융해되는 반면 페난트렌은 101도에서 녹는다. 굽은 구조이다 보니 안트라센에 비해서 고체상태의 결정구조가 치밀하지 못한 탓이다. 비중도 더 낮다. 또 굽은 구조때문에 쌍극자모멘트가 있어서 완벽한 대칭인 안트라센에 비하면 물에 수십배나 더 잘 녹는다. 그래봤자 극소량이긴 하지만.
제법 및 용도[편집 | 원본 편집]
고교 수준이나 학부 저학년 수준에서 페난트렌은 인지도에서 안트라센에 완전히 발려서 "왜 안트라센이 방향족인가?" 정도의 질문도 못받는다(...) 불쌍하다 하지만 대학원 이상의 고급 과정이 되면 똑같이 중요하다. 사실 안트라센보다 훨씬 비싼 귀하신 몸이다 구체적인 전자구조나 반응메커니즘들은 학부 2~3학년 이상 과정에 해당한다. 화학분야 이공계 대학원생이나 화학과나 약학과 학부생이 아닌 이상 사실 접할 기회도 별로 없다.
실제로 페난트렌은 안트라센보다는 열역학적으로 안정하고,[2] 따라서 자연적으로 페난트렌 구조는 안트라센 구조보다 훨씬 빈번하기 때문에 배워야할 내용이 오히려 더 많다. 광물에도 존재하고 생체에도 존재한다.
제법[편집 | 원본 편집]
순수한 페난트렌은 안트라센과 마찬가지로 콜타르에서 분리해서 얻을 수 있으며, 담배연기에도 들어 있다. 아주 특이하게도 페난트렌 결정을 주 성분으로 하는 광물(mineral)이 존재한다. 라바타이트(Ravatite)라고 불리는 광물인데 지구상에 자연발생한 몇 안 되는 유기광물(organic mineral)이다.[3]
이하 외계어 주의
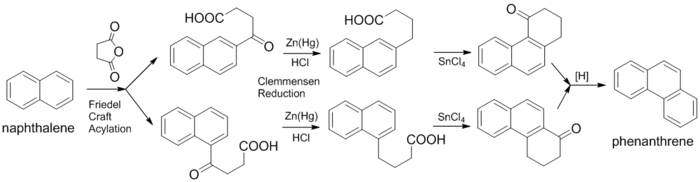
페난트렌을 나프탈렌으로부터 합성할 수 있다. 나프탈렌을 숙신산 무수물과 Friedel-Craft Acylation을 시키면 페난트렌을 합성할 수 있는 프리커서인 4-oxo-4-(2-naphthyl)butanoic acid와 4-oxo-4-(1-naphthyl)butanoic acid가 합성된다. 두 화합물 모두 염산 존재하에서 아연 아말감(Zinc-Mercury Alloy)과 환류해서 Clemmensen 환원을 진행해 산소이탈을 시키고,[4] 염화주석을 이용해 electrophilic acylational annulation을 시키면 환원시켜서 페난트렌을 만들 수 있는 케톤들인 1-oxo-1,2,3,4-tetrahydrophenanthrene 과 4-oxo-1,2,3,4-tetrahydrophenanthrene이 합성된다.[5] 이를 강한 환원제로 환원하고 탈수소화반응을 진행시키면 페난트렌이 합성된다. 이상 외계어 끝네? 뭐라고요?(...)
반응[편집 | 원본 편집]
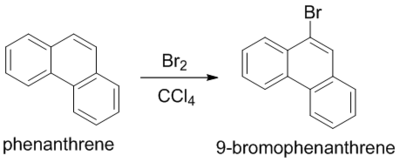
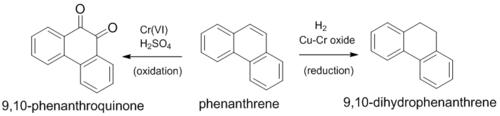
벤젠이 하는 것과 마찬가지로 방향족이기 때문에 친전자성 치환반응을 한다. 9,10-자리가 주로 친전자성 치환반응을 한다. [6][7]
환원과 산화 또한 9,10-자리에서만 일어난다. 여러고리 방향족 탄화수소의 방향족성에 근거한 반응 예측에 관해서는 클라의 법칙(Clah's rule)을 참조.[8]
용도[편집 | 원본 편집]
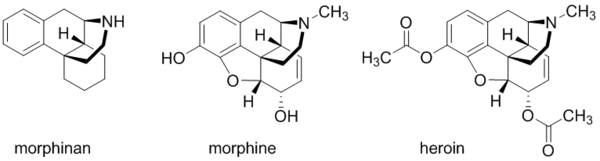
페난트렌 그 자체의 사용처는 드물지만 각종 향정신성의약품 및 마약류에서 흔히 발견되는 모르피난(morphinan)이 페난트렌을 뼈대로 삼고 있다. 모르피난의 구조에서 조금만 더 나가면 모르핀(morphine)이 된다. 이 모르핀을 아세틸화시키면 헤로인(heroin)이 된다.점입가경
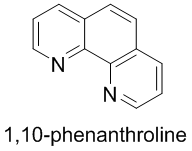
학부 무기화학에서 π-backbonding을 하는 강한장 킬레이트 리간드 중 하나로 1,10-페난트롤린(1,10-phenanthroline, 약칭 phen)이 등장한다. 페난트렌과 페난트롤린의 관계는 벤젠과 피리딘의 관계와 같다. 가장 강한장 로우-스핀 리간드인 일산화탄소(CO)와 시아노기(CN-) 다음으로 강한 d-오비탈 갈라짐을 유발하는 리간드이다.
건강에 미치는 영향[편집 | 원본 편집]
벤젠과 여러고리 방향족 탄화수소가 그렇듯이 안트라센과 마찬가지로 취급시에는 발암물질 또는 발암물질로 의심되는 물질에 준해서 취급해야 한다. 생쥐에 대한 경구 반수치사량이 700mg/kg으로 보고되어 있다.[9] 페난트렌에 대한 구체적인 위험요소는 미국 환경보호청(US EPA)에서 무료로 온라인에서 제공한다.[10]
주요 유도체[편집 | 원본 편집]
- 1,10-페난트롤린(1,10-phenanthroline)
같이 보기[편집 | 원본 편집]
각주
- ↑ '엷을 비(菲)'자로 화학 문맥에서 명사로 쓰이면 '페난트렌'을 특별히 지칭하는 한자어다.
- ↑ Clar, E. (1964). Polycyclic Hydrocarbons. New York: Academic Press. LCCN 63012392
- ↑ http://webmineral.com/data/Ravatite.shtml#.VX6mqEZ2FYw
- ↑ Clemmensen, E. (1913). "Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure". Chemische Berichte 46: 1837
- ↑ A. Streitwieser, 유기화학원론 제 4판, 자유아카데미, p.1156
- ↑ http://pubs.rsc.org/en/Content/ArticleLanding/1956/JR/jr9560003570#!divAbstract
- ↑ http://orgchem.chem.uconn.edu/2444f2011/2444-111811.pdf
- ↑ Clar, E. (1964). Polycyclic Hydrocarbons. New York: Academic Press. LCCN 63012392
- ↑ ScienceLab MSDS-Phenanthrene http://www.sciencelab.com/msds.php?msdsId=9926453
- ↑ 미국 환경보호청 자료 http://www.epa.gov/iris/subst/0459.htm
| 지방족 포화 탄화수소 | |
|---|---|
| 지방족 불포화 탄화수소 | |
| 알코올 | |
| 알데히드 및 케톤 | |
| 유기산 | |
| 에스테르 | |
| 방향족 (여러고리) 탄화수소 | |
| 방향족 기초 화합물 | |
| 방향족 고차구조 | |
| 헤테로고리 화합물 | |
| 생체유기화합물 및 알칼로이드 | |