| IUPAC 명칭 | Tricyclo[8.4.0.03,8]tetradeca-1,3,5,7,9,11,13-heptaene |
|---|---|
| 영문 관용명 | Anthracene Paranaphthalene |
| 한국어 | 안트라센 |
| 일본어 | アントラセン [antorasen] |
| 중국어 | 蒽 [ēn][1] |
| 독일어 | Anthracen |
개요[편집 | 원본 편집]
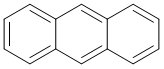
벤젠고리 3개가 일렬로 나열된 형태로 탄소원자 2개씩을 공유해서 만든 여러고리 방향족 탄화수소.
주요 특성[편집 | 원본 편집]
| CAS 일련번호 | 120-12-7 |
|---|---|
| 분자식 (분자량) | C14H10 (178.24g mol-1) |
| 상온 상압에서 성상 | 자극적 냄새가 나는 은비늘같은 형태의 결정성 플레이크 |
| 비중 | 1.28 (STP) |
| 녹는점 / 끓는점 | 215.8℃ / 339.9℃ |
| 용해도(물) | 4μg/100g water |
두 가지 세고리 방향족 탄화수소(polycyclic aromatic hydrocarbon, PAH)중 하나다. 나머지 하나는 페난트렌. 고등학교 교과서에 공식적으로 등장하는 여러고리 방향족 탄화수소 중에서는 사실상 마지막이다. 페난트렌은 고교 교과과정에서는 상대적으로 잘 나오지 않는다. 가격도 안트라센이 훨씬 싸다. 안트라센 결정은 기본적으로 무색을 띄지만 자외선을 쪼이면 청색 형광을 낸다. 총 14개의 전자를 가지고 있어서 휘켈 규칙에 맞아떨어져 방향족으로 예측이 가능하다.
제법 및 용도[편집 | 원본 편집]
안트라센은 "왜 안트라센이 방향족인가?" 정도를 묻는 질문을 제외하면 구체적인 반응들은 대학교 학부 3, 4학년 이상급으로 난이도가 올라간다(...) 이하의 내용도 학부 2학년때 배우는 기초유기화학 교과서에는 안나오는 내용이니 주의를 요함 구조가 복잡해져서 반응할 구석이 많고, 벤젠이나 나프탈렌에 비해 주생성물의 수득률은 떨어지며 경쟁반응의 수득률은 올라가기 때문이다.
제법[편집 | 원본 편집]
콜타르의 1.5%가량이 안트라센으로 이루어져 있다. 따라서 주로 콜타르를 분리해서 안트라센 및 안트라센 유도체를 얻는다.
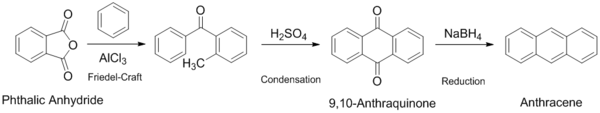
실험실 스케일에서 합성할 수 있는 방법은 여러 가지가 보고되어 있다. 가장 교과서적인 방법은 나프탈렌을 산화시켜 얻어진 프탈산 무수물을 벤젠과 Friedel-Craft Acylation을 통해 반응시킨 후 황산으로 탈수반응을 유도해 안트라퀴논을 생성한 후 그것을 환원해서 안트라센을 만드는 3단계 반응이다.[2]
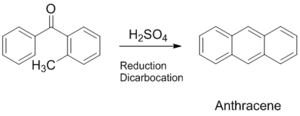
좀 더 간단한 반응으로 오르토-메틸 치환된 벤조페논계 프리커서를 고온고압에서 축합시켜서 안트라센을 얻는 Elb reaction이 있다.[3]
반응[편집 | 원본 편집]
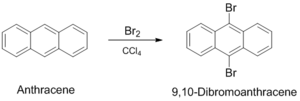
벤젠이 하는 것과 마찬가지로 방향족이기 때문에 친전자성 치환반응을 하며, 대부분 9,10-자리에서 일어난다.[4]
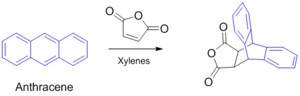
안트라센의 9,10-자리는 반응성이 높고 한편으로는 매우 특이한데, Diels-Alder반응을 할 수 있다.[5] 파란색 부분이 원래 안트라센이었던 부분.
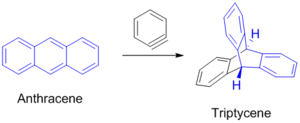
벤자인(Benzyne)[6]과 Diels-Alder반응을 하여 굉장히 특이한 방향족성 탄화수소인 트립티센(trypticene)을 형성한다.[7]
용도[편집 | 원본 편집]
안트라센부터는 합성화학이 아닌 본격적인 재료공학에서 취급되는 물질로 간주되기 시작한다. 밴드갭이 3.7eV로 유기분자지만 반도체 성질을 띠어 단분자형 유기반도체로 취급된다.[8]
의외로 종교적 목적으로도 사용되는 화합물이다. 교황을 선출하는 추기경들의 콘클라베가 열린 후 만약 차기 교황이 선출되지 않았을 경우 굴뚝에 검은 연기를 피워서 외부에 알리는데 안트라센을 태운 그을음이 이 검은 연기의 정체라고 한다. 오오[10] 시그마알드리치가 교황청에 협찬이라도 하나
건강에 미치는 영향[편집 | 원본 편집]
안트라센이 인체에 미치는 영향은 많은 것이 밝혀져 있는 상태는 아니다. 기본적으로 안트라센은 상당히 무거운 분자로 상온에서 안정한 고체 형태로 존재하며 증기압도 매우 낮기 때문이다. 단, 벤젠과 여러고리 방향족 탄화수소가 그렇듯이 취급시에는 발암물질 또는 발암물질로 의심되는 물질에 준해서 취급해야 한다. 일단 미국 환경보호청(US EPA) 자료에 의하면 안트라센은 피부와 내장 기관, 혈액과 림프계에 기능장애를 일으킬 수 있다고 한다. 심할 경우 폐부종을 일으킨 사례가 보고되어 있다.[11]
주요 유도체[편집 | 원본 편집]
- 9,10-안트라퀴논(9,10-anthraquinone)
- 안트론(anthrone)
- 9-안트라놀(9-anthranol)
같이 보기[편집 | 원본 편집]
각주
- ↑ '풀이름 은(蒽)'자로 화학 문맥에서는 '안트라센'을 특별히 지칭하는 한자어다.
- ↑ A. Streitwieser, 유기화학원론(번역) 제4판, 자유아카데미, pp.1155~1156
- ↑ K. Elbs, E. Larsen: Ueber Paraxylylphenylketon, in: Ber. Dtsch. Chem. Ges. 1884, 17, 2847–2849
- ↑ University of Manitoba 자료 http://home.cc.umanitoba.ca/~hultin/chem2220/Support/Electrophilic%20aromatic%20substitution%20in%20polycyclic%20structures.pdf
- ↑ http://www.chm.uri.edu/bdeboef/chm292/D-A_experiment.pdf
- ↑ 벤젠에서 H2가 중성 상태로 빠져나간 분자로 C6H4의 분자식을 갖는다. 그림에 있는 삼중결합은 잘못 그려진 게 아니라 정말로 삼중결합에 해당한다. 분자오비탈 이론(MO theory)에 따르면 벤자인의 삼중결합은 시그마 결합, 수직한 p오피탈의 파이결합에 더해서 불완전한 sp2 오비탈끼리의 파이결합으로 이루어져 있다. 유효 결합차수는 2 이상 3 미만이다. 벤자인은 매우 반응성이 높고 불안정한 분자다.
- ↑ Wittig, George (1959). "Triptycene". Org. Synth 39: 75
- ↑ G. Vaubel, H. Baessler, Determination of the band-gap in anthracene, Physics Letters A, Volume 27, Issue 6, 12 August 1968, Pages 328-329, ISSN 0375-9601
- ↑ http://www.pesticideinfo.org/Detail_Chemical.jsp?Rec_Id=PC35925
- ↑ Vatican Radio, Briefing by Fr. Federico Lombardi, 03/13/2013, 1 p.m. CET
- ↑ 미국 환경보호청 자료 http://www.epa.gov/osw/hazard/wastemin/minimize/factshts/anthrace.pdf
| 지방족 포화 탄화수소 | |
|---|---|
| 지방족 불포화 탄화수소 | |
| 알코올 | |
| 알데히드 및 케톤 | |
| 유기산 | |
| 에스테르 | |
| 방향족 (여러고리) 탄화수소 | |
| 방향족 기초 화합물 | |
| 방향족 고차구조 | |
| 헤테로고리 화합물 | |
| 생체유기화합물 및 알칼로이드 | |