| IUPAC 명칭 | Pyridine |
|---|---|
| 영문 관용명 | Pyridine Azabenzene |
| 한국어 | 피리딘 |
| 일본어 | ピリジン [pirijin] |
| 중국어 | 苯酚 [bǐdìng] |
| 독일어 | Pyridin |
개요
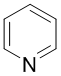
벤젠의 탄소-수소 쌍 하나가 질소원자 하나로 치환된 방향족 헤테로고리 화합물이다.
주요 특성
| CAS 일련번호 | 110-86-1 |
|---|---|
| 분자식 (분자량) | C5H5N (79.10g mol-1) |
| 상온 상압에서 성상 | 생선 냄새가 나는 연한 황색 액체 |
| 비중 | 0.982 (STP) |
| 녹는점 / 끓는점 | -41.6℃ / 115.2℃ |
| 물과의 용해도 | 모든 조성에서 섞임 |
| 염기도 | pKb = 8.75 |
보통 학부 2학년때 배우는 기초유기화학 그 다음단계의 유기화학 중급과정에서 다루는 방향족 헤테로고리 화합물 중 처음으로 등장하는 녀석이다. 벤젠처럼 친전자성 치환반응도 하고 또 3차 아민처럼 거동하는 성질도 가지고 있으며, 질소 원자가 전기음성도 때문에 전자를 일부 끌어당겨서 친핵체의 공격을 받아 별도로 친핵성 치환반응도 하고, 전자배치와 염기도의 관계 등 관련해서 분자 하나만 가지고도 참 할 말이 많기 때문에 숙제나 시험문제내기가 너무너무 좋아서 교수님들이 참 좋아하는 화합물이다(...) 한편으로는 냄새가 썩은 생선을 휘발유에 비빈 것 같은 것이 참으로 거지같기 때문에 대학원생이 되어서도 실험실에서 실물을 만나는 것은 그다지 좋은 느낌은 아니다.
질소의 비공유전자쌍은 평면상에 위치한 sp2 혼성오비탈에 위치하고 있다. 비슷한 오각고리화합물인 피롤의 경우 비공유전자쌍이 고리 평면에 수직한 p오비탈에 위치하고 있다는 사실과 대조적이다. 산염기 특성과 연관지어서 중간기말고사에 잘나온다
제법 및 용도
공업적 제법
기본적으로 피리딘은 콜타르에서 추출할 수 있다. 다만 너무 함량이 낮아서(0.1% 미만) 충분한 양의 피리딘을 얻기 위해서는 괴랄한 양의 콜타르를 처리해야 한다. 또한 분리공정의 횟수도 핵노답이어서 단가를 뽑기도 어려웠다.[1] 그래서 현재는 원하는 피리딘 유도체를 공업화학적으로 직접 합성하고 있다. 주요 공업적 합성법으로 Chichibabin 합성법과 Hantzsch 합성법이 있다.
반응
전술한대로 벤젠과 마찬가지로 친핵성 치환반응을 한다. 고리 안에 들어 있는 질소원자는 니트로기(-NO2)와 같이 강하게 전자를 흡입해서 메타-자리에 주로 반응이 가며 반응성도 벤젠류에 비하면 매우 낮은 편이다. 쌩 피리딘은 너무 반응성이 낮아서 친전자성 치환반응을 용이하게 하기 위해서 알킬기를 달거나 이걸 달면 어떻게 뗄라고 질소원자를 산화시키는 편법(?)이 사용된다.[2]
피리딘은 친전자성 치환반응 이외에 친핵성 치환반응도 하는 참으로 이상한 놈이다(...) 친핵성 치환반응은 오르토-, 파라-자리가 선호되며, 유명한 네임드 반응으로 Chicibabin 반응이 있다.[3]
용도
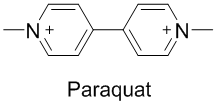
피리딘은 다양한 공업적 용도로 사용되는 화합물이다. 주요한 분야로는 제초제와 고엽제가 있다. 파라쾃(paraquat)은 피리딘으로부터 합성되는 초강력 제초제다.[4] 문제는 이녀석이 지나치게 독한데다가, 파킨슨병 발병의 원인물질로 의심되어서 21세기 들어서 미국에서는 사용에 법적 제한을 받고 유럽에서는 완전히 퇴출되었다.
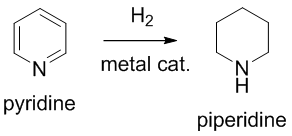
아예 환원시켜서 비방향족 헤테로고리 화합물인 피페리딘을 합성하는데 사용되기도 한다.
그 외에 드물게 유기용매로 사용되기도 하고, 유기금속화학분야에서 유용한 고부가가치 화합물을 합성하는데 리간드로 이용되기도 한다.
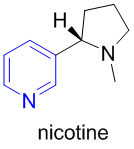
여담이지만 니코틴 분자를 구성하는 주요 파트를 이루기도 한다. 오각형 비방향족 헤테로고리 화합물인 N-메틸피롤리딘과 연결된 형태가 바로 니코틴이다. 파란색이 피리딘 파트.
건강에 미치는 영향
아닐린과 마찬가지로 피리딘은 피부를 통해서 빠르게 흡수되어서 일차적으로 간과 콩팥을 결딴낸다. 발암물질로 의심되지만 실제 발암과 인과관계가 도출된 확실한 증거는 없다. 그보다 더 무서운 것은 실제로 피리딘에 노출되면 정자가 감소한다는 연구 결과가 있다는 점이다.[5] 내가 고자라니 브롬의 고자화(...)기능은 실제로 거의 입증된 바 없는 도시전설에 가깝지만 이쪽은 진짜다. 흠좀무. 에스트로겐 타입의 환경호르몬으로 작용해서 내분비계를 엉망으로 만들 수도 있다. 또 인체의 대사과정에 낑겨서 생화학적으로 변화되어 온갖 해괴한 화합물들로 변하기도 한다.[6] 유기화학 실험실이나 특정 화학공장에서는 흔한 화합물이지만 영접할 때에는(...) 후손을 위해서라도 안전을 꼭 염두에 두고 필요한 보호장비를 착용해야 한다.
주요 유도체
같이 보기
- ↑ A. Gossauer: Struktur und Reaktivität der Biomoleküle, 2006, p. 488, Wiley-VCH Weinheim, ISBN 3-906390-29-2
- ↑ A. Streitwieser, 유기화학원론(번역) 제4판, 자유아카데미, p.1202
- ↑ Chichibabin, A. E.; Zeide, O. A. (1914). "[New Reaction for Compounds Containing the Pyridine Nucleus]". Zhur. Russ. Fiz. Khim. Obshch (J. Russ. Phys. Chem. Soc.) 46: 1216–36
- ↑ http://www.inchem.org/documents/icsc/icsc/eics0005.htm
- ↑ International Agency for Research on Cancer (IARC) (22 August 2000). "Pyridine Summary & Evaluation". IARC Summaries & Evaluations. IPCS INCHEM. Retrieved 17 January 2007.
- ↑ http://gestis-en.itrust.de/nxt/gateway.dll/gestis_en/013850.xml?f=templates$fn=default.htm$3.0